В электротехнике с давних пор используются различные гальванические элементы. Можно сказать, что именно они стояли у истоков научных исследований такого явления, как электричество. Чтобы разобраться в природе электрического тока, необходимо, прежде всего, уяснить, что такое гальванический элемент.
Характеристики
Каждый гальванический элемент является химическим источником тока. Вырабатывание электрической энергии здесь происходит в результате окислительно-восстановительных реакций. Получается прямое преобразование химической энергии в электрический ток.

Стандартный гальванический элемент включает в себя разнородные электроды, в одном из которых содержится окислитель, а в другом восстановитель. В процессе реакции, оба они вступают в контакт с электролитом. По сроку действия, элементы могут быть одноразовыми, многоразовыми и непрерывного действия. Наибольшее распространение получила обыкновенная электрическая батарейка, использующаяся во множестве современных устройств.
Принцип работы
В состав элемента входят два металлических электрода, разнородных по своим физическим свойствам. Как правило, они размещаются в электролите, представляющем собой вязкую или жидкую среду. Когда электроды соединяются с помощью внешней электрической цепи, начинается течение химической реакции. В это время начинается движение электронов от одного электрода к другому, благодаря чему и появляется электрический ток.
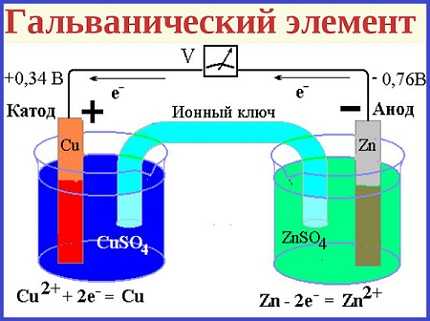
Отрицательный полюс элемента состоит из электрода, теряющего свои электроны, его материалов служат литий или цинк. В процессе реакции, он исполняет роль восстановителя. Соответственно, другой электрод является окислителем и выполняет функцию положительного полюса. Материалом для него служат окислы магния, реже применяется ртуть или соли металлов.
Сам электролит, где находятся электроды, является веществом, не способным в обычных условиях пропускать электрический ток. Когда электрическая цепь становится замкнутой, начинается распад вещества на ионы, благодаря чему появляется электропроводность. Материалами для электролитов, чаще всего, служат растворенные или расплавленные кислоты, а также соли калия и натрия.
Вся конструкция гальванического элемента размещается в металлической емкости. Электроды выполнены в виде металлических сеточек, куда напыляется окислитель и восстановитель. Со временем, электрохимические реакции становятся слабыми, поскольку запасы окислительных и восстановительных материалов постепенно уменьшаются.